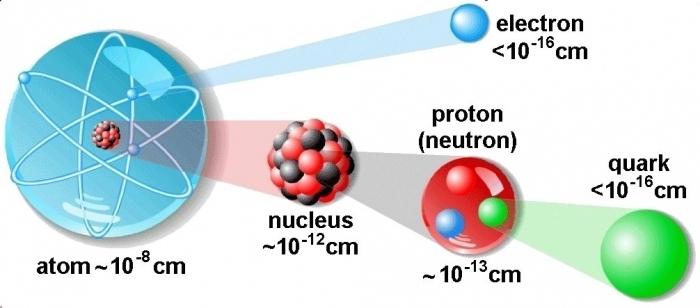
Ūdeņraža atoms ir vienkāršākais elements
Ūdeņradis ir vienkāršākais ķīmiskais elementstās struktūra un visizplatītākā būtība. Saskaņā ar dažiem zinātniskiem datiem šis elements veido vairāk nekā deviņdesmit procentus no visiem atomiem. Vissvarīgākais savienojums, kurā ir ūdeņradis, ir ūdens. Tās ķīmiskā formula ir šāda: H2O. Ūdeņraža atoms sastāv no viena protona, kas attēlo kodolu, un vienu elektronu. Tas ir vienīgais elements, kas ir degoša gāze.
Kā periodiskā tabulā atrodas ūdeņraža atoms?
Šis elements atrodas pirmās grupas augšpusē. Tas tiek darīts tāpēc, ka ūdeņraža atoms, zaudējot savu elektronu, veido vienu pozitīvu jonu ar vienu lādiņu. Tomēr noteiktos apstākļos ūdeņradis var iegūt metāla īpašības. Normālos apstākļos tam piemīt tikai nemetālu īpašības. Ūdeņradim ir būtiskas atšķirības no citiem elementiem, kas pieder pirmajai grupai.
Kā iegūt ūdeņradi laboratorijā?
Ūdeņradi var iegūt, iedarbojotiesnekoncentrētas skābes uz metāliem: Zn (cinks cietā stāvoklī) + 2HCl (sālsskābes ūdens šķīdums) = ZnCl2 (cinka oksīda ūdens šķīdums) + H2 (gāze)
Ražošana no ūdeņraža, izmantojot hidrolīzes: 2H3O- + 2e- = H2 (gāze) + 2H2O (ūdens).
Ūdeņraža ražošana ir iespējama, sārmu iedarbojoties uz alumīniju vai cinku. Šie metāli var reaģēt ar kālija hidroksīda vai kālija hidroksīda ūdens šķīdumiem. Šajā gadījumā veidojas ūdeņradis:
Zn (cinks) + 2OH- + 2H2O = (Zn (OH) 4) 2- (tetrahidroksicikl-ions)) + H2 (gāze)
Al (alumīnijs) + 2OH- + 6H2O = (Al (OH) 4) - (tetrahidroksalalumināta jons) + H2 (gāze).
Arī aktīvs ķīmiskais elements var iegūt, hidrolizējot ūdens šķīdumiem: CaH2 (kalcija hidrīda) + 2H2O (ūdens) = Ca (OH) 2 (kalcija hidroksīda) + 2H2 (ūdeņradis).
Ūdeņraža izotopi
Šīs ķīmiskās vielas ir trīs izotopu formaselements: protium, deitērijs un tritijs. Tajā pašā laikā dabiskais ūdeņradis satur apmēram 99% protium, pārējais ir deitērijs. Trešais izotops ir radioaktīvs, nestabils izotops. Šī iemesla dēļ tas dabā tiek konstatēts tikai kā pēdas. Tritijs izstaro radioaktīvās daļiņas, un tā pusperiods ir 12,3 gadi.
Izotopu ūdeņraža formas ir praktiskitās pašas ķīmiskās īpašības, bet tās fizikālās īpašības ievērojami atšķiras. Katram ūdeņraža savienojumam ir deitērija analogs. Vissvarīgākais no tiem ir deitērija oksīds (vai smags ūdens). Šo vielu izmanto kodolreaktoros. To iegūst, elektrolizējot ūdeni.
Ūdeņraža ķīmiskās īpašības
Attiecīgais ķīmiskais elements var atjaunot 4-7 grupu nemetālus, oksīdus un organiskos nepiesātinātos savienojumus, kā rezultātā oksidēt metālus, veidojot hidrīdus.
Ūdeņraža savienojumi
Tie ir jonu, kompleksie un kovalentie hidrīdi, kā arī hidrīdi, piemēram, interkalācijas savienojumi.
Ūdeņraža ražošana
- Bohra process;
- no dabasgāzes vai ligroīna (ligroīns);
- ogļūdeņražu krekinga un reformēšanas rezultātā;
- izmantojot sālsūdens elektrolīzi (t.i., nātrija hlorīda ūdens šķīdumu).
Ūdeņraža atoms kvantu mehānikā
Ūdeņraža atoms ir svarīgs kvantājo viņam divu ķermeņa problēma ir analittiska vai aptuvena. Šos šķīdumus var izmantot dažādiem ūdeņraža izotopiem, bet ar piemērotu korekciju. Kvantu mehānikā ūdeņraža atomu apraksta ar viļņu divu daļiņu funkciju. To arī uzskata par neiesaistītu elektronu atomu smago kodolu elektrostatiskajā laukā.
Bohra ūdeņraža atoms
1913. gadā Bohrs Nīls ierosināja savu atomu modeliūdeņradis. Tai ir daudz vienkāršojumu un pieņēmumu. Neskatoties uz to, ka modelis nebija gluži pareizi, Bohrs no tā izgudroja radiācijas spektru un iegādājās pareizās atoma enerģijas līmeņu vērtības.