Kāda ir kālija elektroniskā konfigurācija?
Kāda ir kālija elektroniskā konfigurācija? Lai atbildētu uz šo jautājumu, ņemsim vērā atomu struktūru, kā arī noteikumus par elektronu sadalījumu pa līmeņiem un apakšlīmeņiem.
Kvantu mehānika
Aprakstīta kālija elektroniskā konfigurācijaSchrodinger vienādojums. Tas savieno kodola un elektronu mijiedarbības potenciālo enerģiju, kā arī atgrūšanos starp daļiņām ar vienādu maksu. Kvantu mehānika izmanto šī vienādojuma postulātus, izskaidrojot zināmu enerģijas rezervju esamību katrā enerģijas līmenī.

Daudzu elektronu atomi
Kālija elektronisko konfigurāciju reģistrē arPauli aizlieguma princips. Ņemot vērā elektronu viļņu īpatnības, viņš pieņēma, ka katra negatīvā daļiņa atrodas uz "orbitāla", tas ir, tam ir noteikta telpiskā eksistence. Attiecībā uz daudzelektronu atomu, kuram pieder kālijs, katrā orbītā var atrasties ne vairāk kā divi elektroni. Rezultātā tika identificēti četri kvantu skaitļi, kas raksturo elektrona stāvokli aplūkotajā laika intervālā.
Klečkovska likums
Kālija elektronisko konfigurāciju veidopamatojoties uz noteikumu, ko iegūst Klechkovsky. Apskatīsim to sīkāk. Atkarībā no tā, kur atrodas orbītas elektroni, tiem ir noteikts enerģijas daudzums. Pirmkārt, ir daļiņu sadalījums ar mazāku enerģijas rezervi.
Tā kā elektronam galvenā enerģijas raksturiezīme ir galvenais kvantu skaitlis, kas atbilst perioda skaitlim.
Ar daudzelektronu atomu ne tikaipiesaistīšana elektronu kodolam, bet arī atgrūšana starp tām. Pieaugot daļiņu kopējai griešanai, elektronu čaulas enerģija samazinās, un palielinās to elektronu skaits, kam ir tāda paša virziena kustības īpatnējā kustība. Līdzīga atkarība kvantu ķīmijā tiek saukta par Hunda likumu.
Pamatojoties uz šiem diviem noteikumiem,kālija atoma elektroniskā konfigurācija. Atomu spektri ļauj noteikt elektronu pamatstāvokli, tas ir, identificēt tās daļiņas, kurām ir minimālā enerģijas rezerve.
Elektroniskās formulas konstruēšanas būtība daudzelektronu kālija atoms ir pavisam vienkārša: elektroniskajai sistēmai jābūt minimālai enerģijai, kas atbilst Paula izslēgšanas principam.
Elektronu sadalījuma piemēri par enerģijas līmeņiem
Pirms apsvērt, kas ir elektroniskskālija jona konfigurācija, mēs sniedzam vienkāršus piemērus. In ūdeņraža atomele kodols satur vienu pozitīvu protonu. Apkārt kodolam orbītā rotē viens elektrons. Zemes stāvoklī ūdeņraža elektroniskajai formai ir šāda forma: 1s. Ļaujiet mums izpētīt šīs elektronas centru orientācijas īpašības. Saskaņā ar Hunda likumu viņš ir kopīgi vadīts ar kodola aizmuguri.
Hēlijam, kam elementa tabulā ir otrais pasūtījuma numurs, uz vienas orbītas atrodas divi elektroni. Katram no tiem ir ½ spin, ir atšķirīgs rotācijas virziens.
Otra enerģijas līmeņa elementiem ir divi apvalki, katram no tiem ir savs enerģijas avots.
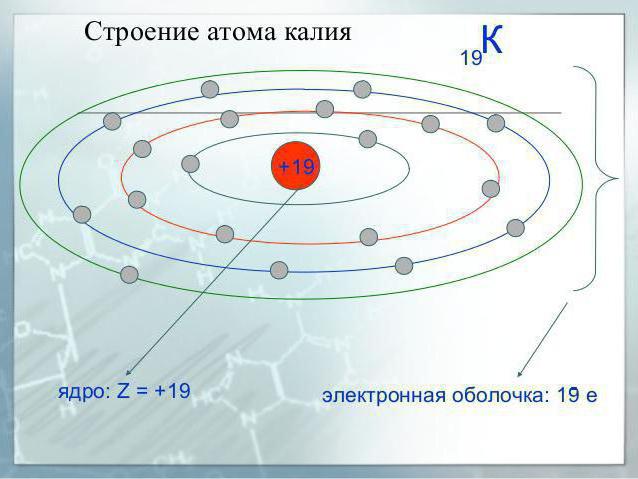
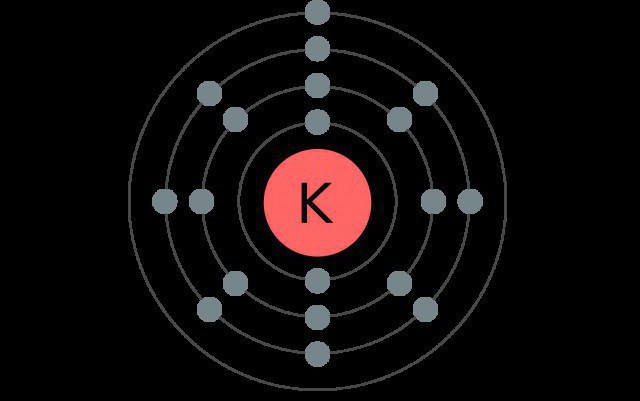
Kālijs ir elementu sistēmas ceturtā perioda elements, tāpēc tam ir četri elektroniskie līmeņi, no kuriem katrs satur dažādus apakšlīmeņus.
Normālā stāvoklī šā sārmu metāla atoms ir ar šādu konfigurāciju: 1s22s22p63s23p64s1.
Kālija jona elektroniskajai konfigurācijai ir atšķirībasno atoma. Metāla ārējā enerģijas līmenī ir viens valences elektrons. Tā kā kālija eksponāti samazinot īpašības, kamēr mijiedarbība ar citiem atomiem, viņš sūta valence elektronu tiek pārvērsts pozitīvs jonu (katjonu) ar øâdu elektronisko konfigurāciju: 1s22s22p63s23p64s0.

Secinājums
Par katru ķīmisko elementukas atrodas periodiskajā tabulā, jūs varat izveidot elektroniskas konfigurācijas, bruņotas ar Hunda likumu, Pauli aizlieguma principu un Klečkovska formulu. Papildus neorganiskās ķīmijas atomu elektroniskajām konfigurācijām veido arī ķīmiskās mijiedarbības rezultātā izveidojušos katijonu un anjonu formulas.








